









Phosphat- und Harnsäuresteine können sich bei Änderung des
pH-Werts
des Harns wieder auflösen. Der hierbei ablaufende Prozeß ist vergleichbar mit
dem Auflösen von Kalk in verdünnten Säuren. CaCO3 Wird nun eine Säure zugegeben, der Lösung also H+-Ionen zugeführt, wird das gelöste Carbonat zu Kohlensäure protoniert. Kohlensäure ist jedoch nicht stabil und zerfällt in Kohlendioxid und Wasser: CO32– + 2 H+
Das Lösungsgleichgewicht wird durch die Entfernung der Carbonat-Ionen verschoben, Kalk löst sich auf. Auch Phosphate können durch Ansäuern gelöst werden: PO43– + 2 H+
Harnsäure ist dagegen eine schwache Säure. Zum Lösen von Harnsäuresteinen muß die Harnsäure in ihre Salze (Urate) überführt, sie also mit Laugen umgesetzt werden. Der Harn muß dafür leicht alkalisiert werden. Da bei pH-Werten > 7 aber Phosphate auskristallisieren können, wodurch die Gefahr der Phosphatmantelbildung besteht, sollte der Harn auf einen pH-Bereich 6,5-7,0 eingestellt werden. |
 Reaktion von Kalk mit Salzsäure |


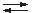 Ca2+ + CO32–
Ca2+ + CO32–